
試驗分期:Ib/II 期
藥物名稱:HRS-1167 片
適應癥:復發性卵巢癌
患者畫像:鉑耐藥復發上皮性卵巢癌、輸卵管癌、原發性腹膜癌患者
試驗專業題目
HRS-1167 聯合貝伐珠單抗治療復發性卵巢癌的開放、多中心Ⅰb/Ⅱ期臨床研究
主要入選標準
1.18~75歲(含邊界值)。
2.細胞學或組織學確診的復發性上皮性卵巢癌、輸卵管癌或原發性腹膜癌。
3.患者既往接受過含鉑方案治療,且在末次鉑類藥物治療期間(自開始治療至末次用藥后1個月內)療效為非 PD,治療結束后6個月(183個日歷日)內發生疾病進展或復發,鉑耐藥后接受系統治療線數≤1 線。
4.至少有一個符合 RECIST v1.1 標準的可測量病灶。
5.ECOG評分:0~1。
6.預期生存期≥12 周。
7.重要器官的功能符合下列要求:
-血常規(篩查前 14 天內未使用任何血液成分、細胞生長因子糾正治療):
a.中性粒細胞絕對計數(ANC)≥1.5×109/L;
b.血小板(PLT)≥ 100×109/L;
c.血紅蛋白(Hb)≥ 90g/L;
-血生化
排除標準
1. 首次用藥前4周內接受過化療、免疫檢查點抑制劑、重大外科手術、抗腫瘤疫苗者;首次用藥前2周內接受過姑息性放療者;口服分子靶向治療(包括其他臨床試驗用靶向藥)距首次研究用藥<5 個藥物半衰期;首次給藥前4周內或可能于研究期間接種活疫苗者。
2. 根據 NCI-CTCAE v5.0分級,既往抗腫瘤治療導致的毒性尚未恢復至≤ 1 級者(淋巴細胞計數降低、脫發、疲勞以及入組標準提及的指標除外;根據研究者的判斷,經與申辦方協商后,部分可耐受的慢性2級毒性可除外)。
3. 受試者既往或同時患有其它惡性腫瘤,除外已治愈的皮膚基底細胞癌,宮頸原位癌,乳腺導管原位癌(DCIS),甲狀腺乳頭狀癌,至首次服藥前經過充分治療并已治愈≥3年且有證據證實無復發轉移的其他惡性腫瘤。
4. 受試者有癌性腦膜炎,或有未經治療的中樞神經系統轉移;既往接受過系統性、根治性腦轉移治療(放療或手術),如影像學證實穩定已維持至少1個月,且已停止全身性激素治療(劑量>10mg/天潑尼松或其他等療效激素)大于2 周、無臨床證狀者可以納入。
5. 影像學顯示腫瘤侵犯大血管或與血管分界不清;或經研究者判斷患者腫瘤在治療期間有極高可能侵襲重要血管而引起致命大出血的情況。
6. 有臨床癥狀的癌性腹水、胸腔積液,需要穿刺、引流者;或在首次服藥前 14 天內接受過腹水、胸腔積液引流者。
7. 腫瘤骨轉移所導致的嚴重骨損傷,包括控制不佳的嚴重骨疼痛,最近6個月內發生的或預計近期很可能發生的重要部位病理性骨折和脊髓壓迫等。
8. 既往或目前有間質性肺炎/間質性肺病(僅影像學改變者除外),需接受糖皮質激素系統治療的肺炎(如放射性肺炎等);目前有活動性肺炎或肺功能檢查證實肺功能重度受損者。
9. 已知對貝伐珠單抗過敏者或對其他單克隆抗體發生過重度過敏反應。
10. 伴有活動性肺結核者;首次用藥前經過充分治療并已停止抗結核治療≥3 個月者可以入組。
11. 患有高血壓,且經降壓藥物治療無法獲得良好控制(收縮壓 ≥ 150 mmHg 或者舒張壓 ≥ 90 mmHg);既往曾出現高血壓危象或高血壓性腦病。
12. 有未能良好控制的心臟臨床癥狀或疾病,如:(1)NYHA2 級及以上心力衰竭或LVEF<50%(2)不穩定型心絞痛(3)首次用藥 1 年內發生過心肌梗死(4)有臨床意義的室上性或室性心律失常需要治療或干預(5)QTc>470msec。
13. 凝血功能異常,具有出血傾向或正在接受溶栓或抗凝治療者,允許試驗期間接受小劑量低分子肝素或口服阿司匹林預防抗凝治療。
14. 首次用藥前4周內發生過 NCI-CTCAE v5.0 分級≥2 級出血事件,包括但不限于咯血(單次發作咯血量≥2mL)、陰道出血、消化道出血等。
15. 首次服藥前6個月內發生過動/靜脈血栓事件,如腦血管意外(包括暫時性缺血性發作、腦出血、腦梗塞)、深靜脈血栓及肺栓塞等;針對下肢肌間靜脈血栓經評估不需接受抗凝治療者、因置管導致的附壁血栓已消失且不需藥物治療者,可以考慮入組。
16. 首次用藥前3個月內發生過消化道穿孔或瘺(人工造瘺除外)、尿道瘺、腹腔膿腫者、腸梗阻或需接受腸外營養者。
17. 無法正常吞咽藥片,或存在胃腸功能異常,經研究者判斷可能影響藥物吸收者。
18. 首次用藥前1個月內發生過嚴重感染的受試者,包括但不限于需要住院治療的感染并發癥、菌血癥、重癥肺炎等;伴有任何需要靜脈注射系統治療的活動性感染的受試者,或在篩選期間、首次給藥前發生原因不明發熱>38.5℃;首次用藥前2 周內使用過抗生素者。
19. 已知有人類免疫缺陷病毒(HIV)檢查陽性病史;已知有活動性肝炎(乙肝參考:HBsAg陽性,且HBV DNA檢測值≥500 IU/mL(若研究中心只有 copy/mL 檢測單位,則≥2500 copy/mL 者不可納入);丙肝參考:HCV 抗體陽性,且 HCV 病毒滴度檢測值超過正常值上限)。
20. 接受 CYP3A4、CYP2D6、P-gp 或 BCRP 強抑制劑治療距首次用藥日期<5 個藥物半衰期或 14 天;接受上述酶強誘導劑治療距首次用藥<28 天。
21. 經研究者判斷,伴有其他可能影響研究結果或導致本研究被迫中途終止的因素,如酗酒、藥物濫用、其他的嚴重疾病(如嚴重的糖尿病、甲狀腺疾病、脊髓壓迫、上腔靜脈綜合征、精神疾病)需要合并治療,有嚴重的實驗室檢查異常,伴有家庭或社會等因素,會影響到受試者的安全。
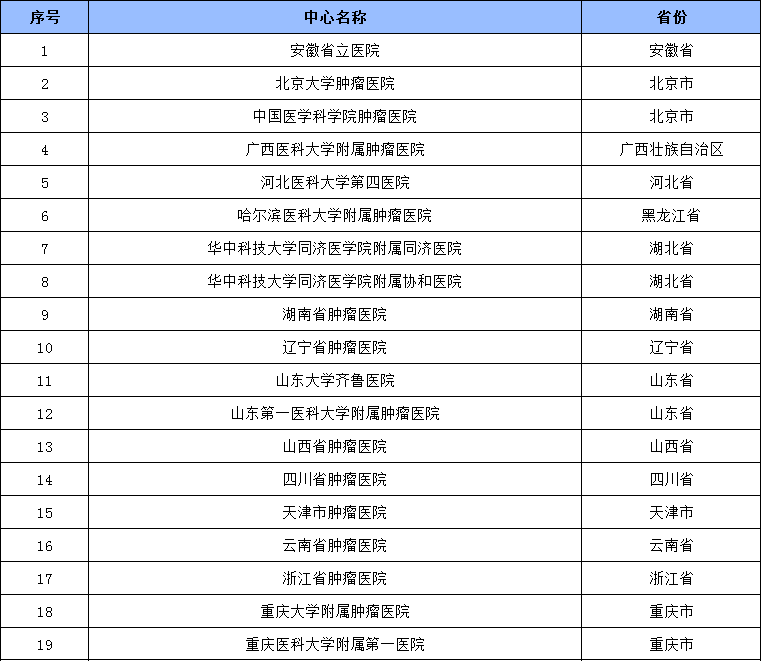
參與機構
試驗分期:Ib/II 期
藥物名稱:HRS-1167 片
適應癥:復發性卵巢癌
患者畫像:鉑耐藥復發上皮性卵巢癌、輸卵管癌、原發性腹膜癌患者
試驗專業題目
HRS-1167 聯合貝伐珠單抗治療復發性卵巢癌的開放、多中心Ⅰb/Ⅱ期臨床研究
主要入選標準
1.18~75歲(含邊界值)。
2.細胞學或組織學確診的復發性上皮性卵巢癌、輸卵管癌或原發性腹膜癌。
3.患者既往接受過含鉑方案治療,且在末次鉑類藥物治療期間(自開始治療至末次用藥后1個月內)療效為非 PD,治療結束后6個月(183個日歷日)內發生疾病進展或復發,鉑耐藥后接受系統治療線數≤1 線。
4.至少有一個符合 RECIST v1.1 標準的可測量病灶。
5.ECOG評分:0~1。
6.預期生存期≥12 周。
7.重要器官的功能符合下列要求:
-血常規(篩查前 14 天內未使用任何血液成分、細胞生長因子糾正治療):
a.中性粒細胞絕對計數(ANC)≥1.5×109/L;
b.血小板(PLT)≥ 100×109/L;
c.血紅蛋白(Hb)≥ 90g/L;
-血生化
排除標準
1. 首次用藥前4周內接受過化療、免疫檢查點抑制劑、重大外科手術、抗腫瘤疫苗者;首次用藥前2周內接受過姑息性放療者;口服分子靶向治療(包括其他臨床試驗用靶向藥)距首次研究用藥<5 個藥物半衰期;首次給藥前4周內或可能于研究期間接種活疫苗者。
2. 根據 NCI-CTCAE v5.0分級,既往抗腫瘤治療導致的毒性尚未恢復至≤ 1 級者(淋巴細胞計數降低、脫發、疲勞以及入組標準提及的指標除外;根據研究者的判斷,經與申辦方協商后,部分可耐受的慢性2級毒性可除外)。
3. 受試者既往或同時患有其它惡性腫瘤,除外已治愈的皮膚基底細胞癌,宮頸原位癌,乳腺導管原位癌(DCIS),甲狀腺乳頭狀癌,至首次服藥前經過充分治療并已治愈≥3年且有證據證實無復發轉移的其他惡性腫瘤。
4. 受試者有癌性腦膜炎,或有未經治療的中樞神經系統轉移;既往接受過系統性、根治性腦轉移治療(放療或手術),如影像學證實穩定已維持至少1個月,且已停止全身性激素治療(劑量>10mg/天潑尼松或其他等療效激素)大于2 周、無臨床證狀者可以納入。
5. 影像學顯示腫瘤侵犯大血管或與血管分界不清;或經研究者判斷患者腫瘤在治療期間有極高可能侵襲重要血管而引起致命大出血的情況。
6. 有臨床癥狀的癌性腹水、胸腔積液,需要穿刺、引流者;或在首次服藥前 14 天內接受過腹水、胸腔積液引流者。
7. 腫瘤骨轉移所導致的嚴重骨損傷,包括控制不佳的嚴重骨疼痛,最近6個月內發生的或預計近期很可能發生的重要部位病理性骨折和脊髓壓迫等。
8. 既往或目前有間質性肺炎/間質性肺病(僅影像學改變者除外),需接受糖皮質激素系統治療的肺炎(如放射性肺炎等);目前有活動性肺炎或肺功能檢查證實肺功能重度受損者。
9. 已知對貝伐珠單抗過敏者或對其他單克隆抗體發生過重度過敏反應。
10. 伴有活動性肺結核者;首次用藥前經過充分治療并已停止抗結核治療≥3 個月者可以入組。
11. 患有高血壓,且經降壓藥物治療無法獲得良好控制(收縮壓 ≥ 150 mmHg 或者舒張壓 ≥ 90 mmHg);既往曾出現高血壓危象或高血壓性腦病。
12. 有未能良好控制的心臟臨床癥狀或疾病,如:(1)NYHA2 級及以上心力衰竭或LVEF<50%(2)不穩定型心絞痛(3)首次用藥 1 年內發生過心肌梗死(4)有臨床意義的室上性或室性心律失常需要治療或干預(5)QTc>470msec。
13. 凝血功能異常,具有出血傾向或正在接受溶栓或抗凝治療者,允許試驗期間接受小劑量低分子肝素或口服阿司匹林預防抗凝治療。
14. 首次用藥前4周內發生過 NCI-CTCAE v5.0 分級≥2 級出血事件,包括但不限于咯血(單次發作咯血量≥2mL)、陰道出血、消化道出血等。
15. 首次服藥前6個月內發生過動/靜脈血栓事件,如腦血管意外(包括暫時性缺血性發作、腦出血、腦梗塞)、深靜脈血栓及肺栓塞等;針對下肢肌間靜脈血栓經評估不需接受抗凝治療者、因置管導致的附壁血栓已消失且不需藥物治療者,可以考慮入組。
16. 首次用藥前3個月內發生過消化道穿孔或瘺(人工造瘺除外)、尿道瘺、腹腔膿腫者、腸梗阻或需接受腸外營養者。
17. 無法正常吞咽藥片,或存在胃腸功能異常,經研究者判斷可能影響藥物吸收者。
18. 首次用藥前1個月內發生過嚴重感染的受試者,包括但不限于需要住院治療的感染并發癥、菌血癥、重癥肺炎等;伴有任何需要靜脈注射系統治療的活動性感染的受試者,或在篩選期間、首次給藥前發生原因不明發熱>38.5℃;首次用藥前2 周內使用過抗生素者。
19. 已知有人類免疫缺陷病毒(HIV)檢查陽性病史;已知有活動性肝炎(乙肝參考:HBsAg陽性,且HBV DNA檢測值≥500 IU/mL(若研究中心只有 copy/mL 檢測單位,則≥2500 copy/mL 者不可納入);丙肝參考:HCV 抗體陽性,且 HCV 病毒滴度檢測值超過正常值上限)。
20. 接受 CYP3A4、CYP2D6、P-gp 或 BCRP 強抑制劑治療距首次用藥日期<5 個藥物半衰期或 14 天;接受上述酶強誘導劑治療距首次用藥<28 天。
21. 經研究者判斷,伴有其他可能影響研究結果或導致本研究被迫中途終止的因素,如酗酒、藥物濫用、其他的嚴重疾病(如嚴重的糖尿病、甲狀腺疾病、脊髓壓迫、上腔靜脈綜合征、精神疾病)需要合并治療,有嚴重的實驗室檢查異常,伴有家庭或社會等因素,會影響到受試者的安全。
參與機構
