
試驗信息
試驗分期:II期
藥品名稱:PM8002
適應癥:神經內分泌瘤
試驗專業題目
評價PM8002注射液聯合化療二線治療不可手術神經內分泌腫瘤受試者的初步療效、安全性及藥代動力學特征的II期臨床試驗
入選標準
1、自愿參加臨床研究;完全了解本研究并自愿簽署知情同意書;愿意遵循并有能力完成所有試驗程序;
2、男性或女性,年齡≥ 18歲;
3、經本研究病理診斷確認為組織學或細胞學確診的不能手術切除的局部晚期或轉移性Ki-67 ≥ 55% G3 NET和NEC(包括混合性神經內分泌-非神經內分泌腫瘤[神經內分泌癌成分至少占30%及以上],不包括SCLC和Merkel細胞癌),病理診斷以2022 WHO神經內分泌腫瘤分類為標準;
4、既往接受過含鉑方案一線化療失敗(包含進展和不耐受)的神經內分泌腫瘤患者;接受新輔助、輔助治療的患者,治療期間或末次治療后6個月內疾病復發視為一線治療失敗;
5、明確有符合RECIST1.1要求的可測量病灶;如果既往接受過局部治療(放療、消融、血管介入等)的病灶是唯一病灶,則必須有該病灶疾病進展的明確影像學依據,不接受將僅有的骨轉移病灶或僅有的中樞神經系統轉移病灶作為可測量病灶;
6、有充足的器官功能(在開始研究藥物治療前14天內,未接受輸血、促紅細胞生成素、粒細胞集落刺激因子、白蛋白或其他醫學支持的情況下),定義如下:
6.1)血液系統:
a)中性粒細胞計數(ANC)≥ 1.5×109/L;
b)血小板計數(PLT)≥ 100×109/L;
c)血紅蛋白(Hb)≥ 90 g/L;
6.2)肝功能:
a)谷草轉氨酶(AST)或谷丙轉氨酶(ALT)水平≤3×ULN,肝轉移受試者應≤5×ULN;
b)總膽紅素(TBIL)≤1.5×正常上限(ULN),肝轉移受試者應≤2×ULN
6.3)腎功能:
a)血清肌酐 ≤ 1.5 × ULN或肌酐清除率≥ 50 ml/min(Cockcroft-Gault公式:([140-年齡]×體重[kg]×[0.85,僅對于女性])/(72×肌酐(mg/dL)));(肌酐單位換算:1 mg/dL = 88.4 μmol/L);
b)尿蛋白定性≤1+;若尿蛋白定性≥2+,則需進行24 h尿蛋白定量檢查,若24 h尿蛋白定量<1g,則可以接受;
6.4)凝血功能:
國際標準化比值(INR)、部分凝血活酶時間(APTT)、凝血酶原時間(PT)≤ 1.5 ×ULN;
7、美國東部腫瘤協作組(ECOG)體力狀況(PS)評分為0~1;
8、預期生存期 ≥ 12周;
9、受試者應在篩選期提供(最長不超過24個月)經福爾馬林固定-石蠟包埋(FFPE)處理的腫瘤樣本:
9.1)未染色切片(3 ~5 μm)用于病理診斷;
9.2)未染色切片(3 ~5 μm)用于PD-L1表達水平回顧性分析;如不能提供病理診斷和/或供PD-L1回顧性分析的腫瘤組織標本,受試者應在篩選期進行新鮮腫瘤病灶活檢(不接受骨活檢、細針穿刺活檢及胸腹水樣本;也不接受對僅有唯一靶病灶可供活檢的受試者進行活檢),以獲得足夠的合格腫瘤組織標本用于病理診斷和/或生物標志物分析; 如受試者因特殊原因無法提供符合上述要求的標本,經與申辦方溝通后決定受試者是否可以參與篩選。
10、有生育能力的女性受試者開始研究治療前7天內的血妊娠結果為陰性,且愿意從簽署知情同意書起至末次用藥結束后6個月內,保持禁欲或采取經醫學認可的高效避孕措施(如宮內節育器、避孕套);
11、男性受試者愿意從簽署知情同意書起至末次用藥結束后6個月內,禁欲或采取經醫學認可的高效避孕措施,且在此期間不捐獻精子。
排除標準
1、嚴重過敏性疾病史、藥物(含未上市的試驗藥物)嚴重過敏史或已知對本研究藥物任何成分過敏;
2、既往接受過任何抗程序性死亡受體1(PD-1)抗體、抗PD-L1抗體、抗PD-L2抗體或抗細胞毒T淋巴細胞相關抗原-4(CTLA-4)抗體或作用于T細胞協同刺激或檢查點通路的任何其它抗體(如OX40、CD137等);3、既往接受過伊立替康治療; 4、既往接受過抗血管內皮生長因子(VEGF)/血管內皮生長因子受體(VEGFR)或小分子TKI治療; 5、已知UGT1A1 酶活性減低(比如UGT1A1*28或UGT1A1*6基因純合型的患者); 6、伴隨用藥中有或者接受研究藥物治療前14天內使用過CYP3A4強誘導劑(苯妥英或卡馬西平、巴比妥類藥物、利福平、利福布汀或利福噴汀、貫葉連翹等);或CYP3A4強抑制劑(克拉霉素、酮康唑或伊曲康唑、茚地那韋、阿扎那韋、洛匹那韋、萘法唑酮、奈非那韋、利托那韋、沙奎那韋、特拉匹韋、伏立康唑等);或UGT1A1強抑制劑(阿扎那韋、吉非羅齊、茚地那韋等),或在研究期間以上藥物不能暫停給藥的患者;
7、具有臨床癥狀的腦實質轉移或腦膜轉移,經研究者判斷不適合入組;
8、具有重大出凝血障礙或其他明顯出血風險證據:
(1)顱內出血或脊髓內出血病史;
(2)腫瘤病灶侵犯大血管且具有明顯出血風險者;
(3)開始研究治療前6個月內,發生過血栓形成或栓塞事件(無癥狀且無需治療的肌間靜脈血栓除外),或患有顯著的血管疾病(如需手術修復的主動脈瘤);
(4)開始研究治療前6個月內出現任何原因的臨床顯著的咯血或腫瘤出血;
(5)開始研究治療前6個月內出現過食管和/或胃靜脈曲張出血;
(6)開始研究治療前2周內,使用出于治療目的的抗凝治療(低分子量肝素除外);
(7)開始研究治療前10天內,使用抗血小板藥物治療,如阿司匹林(> 325 mg/天)、氯吡格雷(> 75 mg/天)、雙嘧達莫、噻氯匹定或西洛他唑等,或需要長期抗血小板治療者;
9、在開始研究藥物治療前接受過以下治療或藥物;
(1)開始研究藥物治療前4周內接受過重要臟器外科手術(不包括穿刺活檢)或出現過顯著外傷,或需要在試驗期間接受擇期手術;
(2)開始研究治療前4周內接受過化療、放療、生物治療、內分泌治療等抗腫瘤治療,或接受過任何其他未上市研究藥物的治療;以下情況也需排除:開始研究治療前6周內接受過亞硝基脲或絲裂霉素C治療;開始研究治療前2周或藥物的5個半衰期內(以時間長者為準)接受過口服氟尿嘧啶類和小分子靶向藥物治療;開始研究治療前2周內接受過有抗腫瘤適應癥的中藥治療;
(3)開始研究藥物治療前14天內接受過全身免疫刺激劑治療(如胸腺肽、干擾素-α [IFN-α]、白介素-2 [IL-2])或仍處于治療藥物的5個半衰期內(取二者中較長者);
(4)開始研究藥物治療前14天內接受過全身使用的糖皮質激素(強的松 > 10 mg/天或等價劑量的同類藥物)或其他免疫抑制劑治療;除外以下情況:使用局部、眼部、關節腔內、鼻內和吸入型糖皮質激素治療;短期使用糖皮質激素進行預防治療(如預防奧沙利鉑所致嘔吐、造影劑過敏);
(5)開始研究藥物治療前4周內接種過減毒活疫苗;
10、既往接受過抗腫瘤治療的受試者必須所有治療相關毒性恢復至≤ 1級,且無需皮質醇激素治療(研究者判斷無安全風險的毒性除外,如脫發、2級外周神經毒性、經激素替代治療穩定的甲狀腺功能減退等);
11、患有慢性炎性腸病和/或腸梗阻;
12、患有活動性、或曾患過且有復發可能的自身免疫性疾病的受試者(如系統性紅斑狼瘡,類風濕性關節炎,血管炎等),除外臨床穩定的自身免疫甲狀腺病、I型糖尿病受試者;
13、開始研究藥物治療前6個月內,出現以下情況:
(1)急性冠脈綜合征、冠狀動脈旁路移植術、充血性心力衰竭、主動脈夾層、腦卒中或其他3級及以上心腦血管事件;
(2)經Fridericia法校正的QT間期(QTcF)均值,男性>450 ms,女性 > 470 ms;
(3)存在任何增加QTc延長風險或心律失常風險的因素,如心衰、低鉀血癥、先天性長QT綜合癥、或正在使用任何已知可延長QT間期的伴隨藥物;
(4)美國紐約心臟病協會(NYHA)心功能分級≥II級,或左室射血分數(LVEF)< 50%;
(5)使用心臟起搏器;
14、目前存在無法控制的胸腔、心包、腹腔積液;
15、目前存在需要靜脈抗感染治療的活動性感染者(如結核或者梅毒);或2周內接受過靜脈抗感染治療;
參與機構
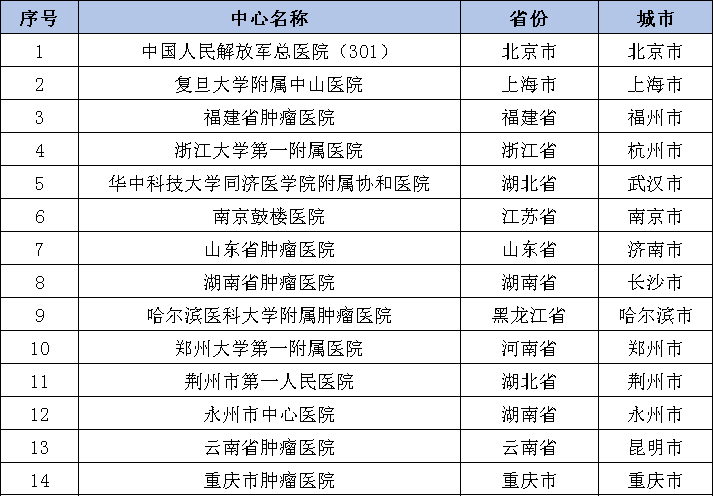
試驗信息
試驗分期:II期
藥品名稱:PM8002
適應癥:神經內分泌瘤
試驗專業題目
評價PM8002注射液聯合化療二線治療不可手術神經內分泌腫瘤受試者的初步療效、安全性及藥代動力學特征的II期臨床試驗
入選標準
1、自愿參加臨床研究;完全了解本研究并自愿簽署知情同意書;愿意遵循并有能力完成所有試驗程序;
2、男性或女性,年齡≥ 18歲;
3、經本研究病理診斷確認為組織學或細胞學確診的不能手術切除的局部晚期或轉移性Ki-67 ≥ 55% G3 NET和NEC(包括混合性神經內分泌-非神經內分泌腫瘤[神經內分泌癌成分至少占30%及以上],不包括SCLC和Merkel細胞癌),病理診斷以2022 WHO神經內分泌腫瘤分類為標準;
4、既往接受過含鉑方案一線化療失敗(包含進展和不耐受)的神經內分泌腫瘤患者;接受新輔助、輔助治療的患者,治療期間或末次治療后6個月內疾病復發視為一線治療失敗;
5、明確有符合RECIST1.1要求的可測量病灶;如果既往接受過局部治療(放療、消融、血管介入等)的病灶是唯一病灶,則必須有該病灶疾病進展的明確影像學依據,不接受將僅有的骨轉移病灶或僅有的中樞神經系統轉移病灶作為可測量病灶;
6、有充足的器官功能(在開始研究藥物治療前14天內,未接受輸血、促紅細胞生成素、粒細胞集落刺激因子、白蛋白或其他醫學支持的情況下),定義如下:
6.1)血液系統:
a)中性粒細胞計數(ANC)≥ 1.5×109/L;
b)血小板計數(PLT)≥ 100×109/L;
c)血紅蛋白(Hb)≥ 90 g/L;
6.2)肝功能:
a)谷草轉氨酶(AST)或谷丙轉氨酶(ALT)水平≤3×ULN,肝轉移受試者應≤5×ULN;
b)總膽紅素(TBIL)≤1.5×正常上限(ULN),肝轉移受試者應≤2×ULN
6.3)腎功能:
a)血清肌酐 ≤ 1.5 × ULN或肌酐清除率≥ 50 ml/min(Cockcroft-Gault公式:([140-年齡]×體重[kg]×[0.85,僅對于女性])/(72×肌酐(mg/dL)));(肌酐單位換算:1 mg/dL = 88.4 μmol/L);
b)尿蛋白定性≤1+;若尿蛋白定性≥2+,則需進行24 h尿蛋白定量檢查,若24 h尿蛋白定量<1g,則可以接受;
6.4)凝血功能:
國際標準化比值(INR)、部分凝血活酶時間(APTT)、凝血酶原時間(PT)≤ 1.5 ×ULN;
7、美國東部腫瘤協作組(ECOG)體力狀況(PS)評分為0~1;
8、預期生存期 ≥ 12周;
9、受試者應在篩選期提供(最長不超過24個月)經福爾馬林固定-石蠟包埋(FFPE)處理的腫瘤樣本:
9.1)未染色切片(3 ~5 μm)用于病理診斷;
9.2)未染色切片(3 ~5 μm)用于PD-L1表達水平回顧性分析;如不能提供病理診斷和/或供PD-L1回顧性分析的腫瘤組織標本,受試者應在篩選期進行新鮮腫瘤病灶活檢(不接受骨活檢、細針穿刺活檢及胸腹水樣本;也不接受對僅有唯一靶病灶可供活檢的受試者進行活檢),以獲得足夠的合格腫瘤組織標本用于病理診斷和/或生物標志物分析; 如受試者因特殊原因無法提供符合上述要求的標本,經與申辦方溝通后決定受試者是否可以參與篩選。
10、有生育能力的女性受試者開始研究治療前7天內的血妊娠結果為陰性,且愿意從簽署知情同意書起至末次用藥結束后6個月內,保持禁欲或采取經醫學認可的高效避孕措施(如宮內節育器、避孕套);
11、男性受試者愿意從簽署知情同意書起至末次用藥結束后6個月內,禁欲或采取經醫學認可的高效避孕措施,且在此期間不捐獻精子。
排除標準
1、嚴重過敏性疾病史、藥物(含未上市的試驗藥物)嚴重過敏史或已知對本研究藥物任何成分過敏;
2、既往接受過任何抗程序性死亡受體1(PD-1)抗體、抗PD-L1抗體、抗PD-L2抗體或抗細胞毒T淋巴細胞相關抗原-4(CTLA-4)抗體或作用于T細胞協同刺激或檢查點通路的任何其它抗體(如OX40、CD137等);3、既往接受過伊立替康治療; 4、既往接受過抗血管內皮生長因子(VEGF)/血管內皮生長因子受體(VEGFR)或小分子TKI治療; 5、已知UGT1A1 酶活性減低(比如UGT1A1*28或UGT1A1*6基因純合型的患者); 6、伴隨用藥中有或者接受研究藥物治療前14天內使用過CYP3A4強誘導劑(苯妥英或卡馬西平、巴比妥類藥物、利福平、利福布汀或利福噴汀、貫葉連翹等);或CYP3A4強抑制劑(克拉霉素、酮康唑或伊曲康唑、茚地那韋、阿扎那韋、洛匹那韋、萘法唑酮、奈非那韋、利托那韋、沙奎那韋、特拉匹韋、伏立康唑等);或UGT1A1強抑制劑(阿扎那韋、吉非羅齊、茚地那韋等),或在研究期間以上藥物不能暫停給藥的患者;
7、具有臨床癥狀的腦實質轉移或腦膜轉移,經研究者判斷不適合入組;
8、具有重大出凝血障礙或其他明顯出血風險證據:
(1)顱內出血或脊髓內出血病史;
(2)腫瘤病灶侵犯大血管且具有明顯出血風險者;
(3)開始研究治療前6個月內,發生過血栓形成或栓塞事件(無癥狀且無需治療的肌間靜脈血栓除外),或患有顯著的血管疾病(如需手術修復的主動脈瘤);
(4)開始研究治療前6個月內出現任何原因的臨床顯著的咯血或腫瘤出血;
(5)開始研究治療前6個月內出現過食管和/或胃靜脈曲張出血;
(6)開始研究治療前2周內,使用出于治療目的的抗凝治療(低分子量肝素除外);
(7)開始研究治療前10天內,使用抗血小板藥物治療,如阿司匹林(> 325 mg/天)、氯吡格雷(> 75 mg/天)、雙嘧達莫、噻氯匹定或西洛他唑等,或需要長期抗血小板治療者;
9、在開始研究藥物治療前接受過以下治療或藥物;
(1)開始研究藥物治療前4周內接受過重要臟器外科手術(不包括穿刺活檢)或出現過顯著外傷,或需要在試驗期間接受擇期手術;
(2)開始研究治療前4周內接受過化療、放療、生物治療、內分泌治療等抗腫瘤治療,或接受過任何其他未上市研究藥物的治療;以下情況也需排除:開始研究治療前6周內接受過亞硝基脲或絲裂霉素C治療;開始研究治療前2周或藥物的5個半衰期內(以時間長者為準)接受過口服氟尿嘧啶類和小分子靶向藥物治療;開始研究治療前2周內接受過有抗腫瘤適應癥的中藥治療;
(3)開始研究藥物治療前14天內接受過全身免疫刺激劑治療(如胸腺肽、干擾素-α [IFN-α]、白介素-2 [IL-2])或仍處于治療藥物的5個半衰期內(取二者中較長者);
(4)開始研究藥物治療前14天內接受過全身使用的糖皮質激素(強的松 > 10 mg/天或等價劑量的同類藥物)或其他免疫抑制劑治療;除外以下情況:使用局部、眼部、關節腔內、鼻內和吸入型糖皮質激素治療;短期使用糖皮質激素進行預防治療(如預防奧沙利鉑所致嘔吐、造影劑過敏);
(5)開始研究藥物治療前4周內接種過減毒活疫苗;
10、既往接受過抗腫瘤治療的受試者必須所有治療相關毒性恢復至≤ 1級,且無需皮質醇激素治療(研究者判斷無安全風險的毒性除外,如脫發、2級外周神經毒性、經激素替代治療穩定的甲狀腺功能減退等);
11、患有慢性炎性腸病和/或腸梗阻;
12、患有活動性、或曾患過且有復發可能的自身免疫性疾病的受試者(如系統性紅斑狼瘡,類風濕性關節炎,血管炎等),除外臨床穩定的自身免疫甲狀腺病、I型糖尿病受試者;
13、開始研究藥物治療前6個月內,出現以下情況:
(1)急性冠脈綜合征、冠狀動脈旁路移植術、充血性心力衰竭、主動脈夾層、腦卒中或其他3級及以上心腦血管事件;
(2)經Fridericia法校正的QT間期(QTcF)均值,男性>450 ms,女性 > 470 ms;
(3)存在任何增加QTc延長風險或心律失常風險的因素,如心衰、低鉀血癥、先天性長QT綜合癥、或正在使用任何已知可延長QT間期的伴隨藥物;
(4)美國紐約心臟病協會(NYHA)心功能分級≥II級,或左室射血分數(LVEF)< 50%;
(5)使用心臟起搏器;
14、目前存在無法控制的胸腔、心包、腹腔積液;
15、目前存在需要靜脈抗感染治療的活動性感染者(如結核或者梅毒);或2周內接受過靜脈抗感染治療;
參與機構
