
試驗信息
試驗分期:II期
藥品名稱:BW-00112 注射液
適應癥:重度高甘油三酯血癥患者
患者畫像:年齡不超過 75 周歲,TG (高油三脂)≥ 500 mg/dL(5.6 mmol/L)且≤ 4000 mg/dL(45 mmol/L)的重度高甘油三酯血癥患者
注:邊緣升高:甘油三酯水平在 1.7~2.3 mmol/L;升高:血清甘油三酯水平在 2.3~5.6 mmol/L;重度升高:血清甘油三酯水平大于 5.6 mmol/L。
試驗專業題目
一項2期、隨機、雙盲、安慰劑對照、平行研究,旨在評估皮下注射BW-00112治療重度高甘油三酯血癥受試者的有效性和安全性
主要入選標準
1.知情同意時年齡為 18 歲至 75 歲(含)的男性或女性。
2.篩選時有 TG ≥ 500 mg/dL(5.6 mmol/L)且 ≤ 4000 mg/dL(45 mmol/L)的病史證據。
3.篩選時至少有兩次檢測空腹 TG ≥ 500mg/dL(5.6 mmol/L)。
4.接受穩定的調脂飲食,加藥物(例如他汀類、煙酸、omega-3 脂肪酸)
治療,調脂飲食和藥物劑量應在篩選前穩定至少 4 周(貝特類 6 周,PCSK9 抑制劑 8 周)。
5.篩選時體質指數(BMI)為 18-40 kg/㎡(含)。
6.愿意在整個研究期間維持之前推薦的飲食和運動方案,遵守生活方式的要求。
7.愿意在整個研究期間,男性每周飲酒不超過 21 單位,女性每周飲酒不超過 14 單位。愿意在每次研究訪視前 24 小時內避免飲酒。
8.女性須處于非妊娠期和非哺乳期,或是手術絕育或絕經后。有生育能力的女性如果她們在篩選前 28 天至最后一次給藥后 24 周內使用高效避孕方法,則可以參加。
9.如果男性受試者的伴侶在篩選至最后一次給藥后 24 周內可能妊娠,則男性受試者同意使用可接受的避孕方法。
排除標準
1.首次給藥第 1 天前 12 周內發生急性胰腺炎。
2. 首次給藥第 1 天前 24 周內發生急性心血管事件或手術或在研究期間計劃接受這些手術。
3. 首次給藥第 1 天前 12 周內接受過較大的手術、有重大外傷或在研究期間需要接受住院治療的擇期手術的受試者。
4. 受試者篩選時有未控制的高血壓。
5. 篩選時心力衰竭紐約心功能分級(NYHA)為 2、3、4 級或已知的左室射血分數<30%。
6. 任何會影響血脂或脂蛋白的有臨床意義的未控制性疾病。
7. 有腫瘤史或現病史,已治愈的皮膚基底細胞癌或鱗狀細胞癌或子宮頸原位癌除外。
8. 任何研究者認為會導致受試者面臨風險,干擾參與研究或干擾研究結果的醫學或精神狀況。
9. 首次給藥第 1 天前 5 年內有酒精和/或藥物濫用史。
10. 首次給藥第 1 天前 6 個月內使用洛美他派或 4 周內接受血脂分離或血漿置換或計劃在研究期間接受這些治療。
11. 乙酰半乳糖胺(GalNAc)過敏反應史。
12. 首次給藥第 1 天前 12 個月內使用寡核苷酸。
13. 首次給藥第 1 天前 30 天或 5 個半衰期(以較長者為準)內參加過其他藥物臨床試驗者。
14. 篩選時臨床實驗室檢查異常。
15. 人類免疫缺陷病毒(HIV)感染、乙型肝炎病毒(HBV)血清陽性、丙型肝炎病毒(HCV)血清陽性或梅毒感染。
16. 篩選時任何有臨床意義的 12 導聯心電圖發現使受試者參與研究面臨風險或干擾。
17. 篩選前 30 天內獻血或失血超過 200mL。
18. 研究者判斷受試者不適合入組或干擾參與或完成研究的任何情況。
參與機構
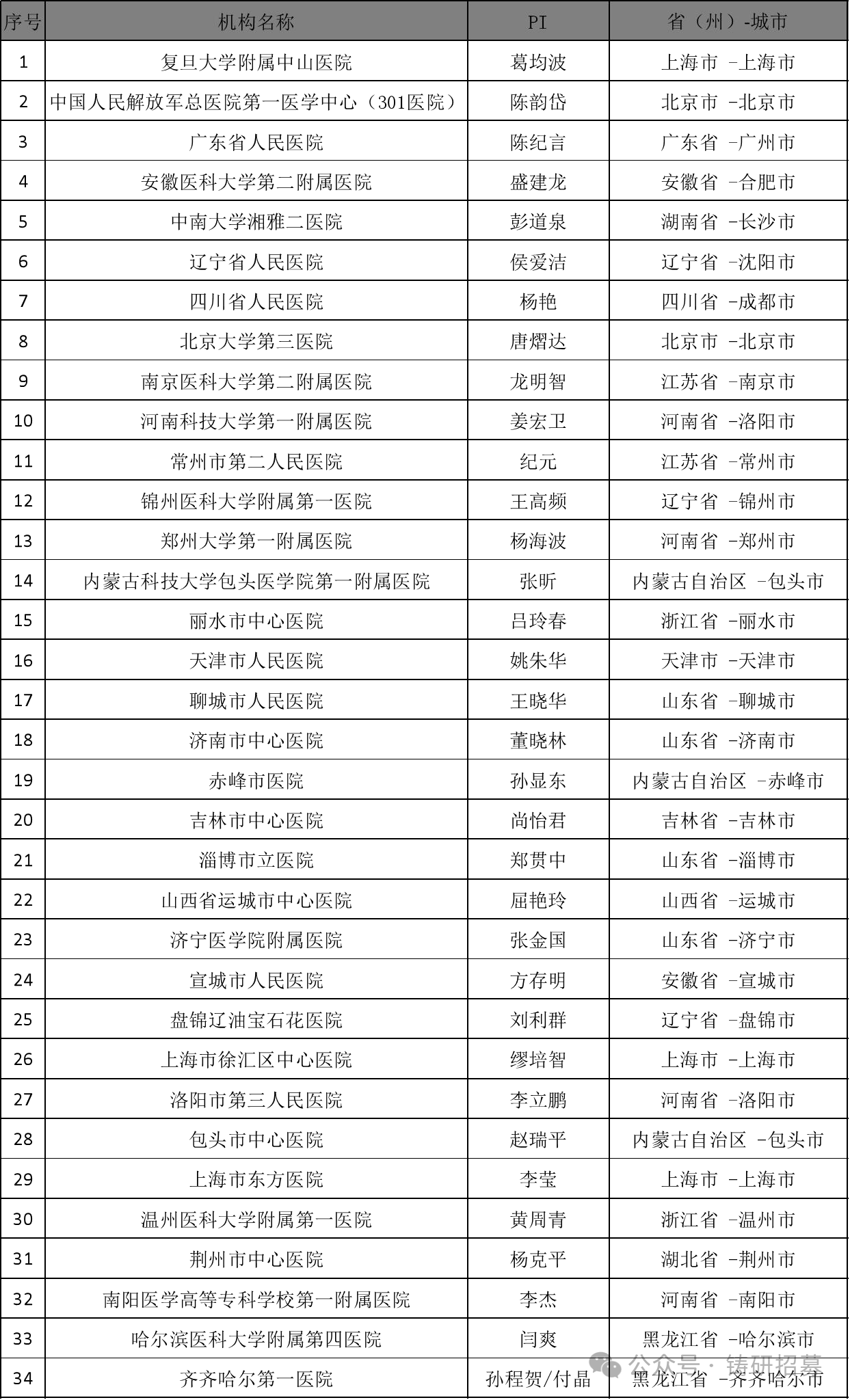
試驗信息
試驗分期:II期
藥品名稱:BW-00112 注射液
適應癥:重度高甘油三酯血癥患者
患者畫像:年齡不超過 75 周歲,TG (高油三脂)≥ 500 mg/dL(5.6 mmol/L)且≤ 4000 mg/dL(45 mmol/L)的重度高甘油三酯血癥患者
注:邊緣升高:甘油三酯水平在 1.7~2.3 mmol/L;升高:血清甘油三酯水平在 2.3~5.6 mmol/L;重度升高:血清甘油三酯水平大于 5.6 mmol/L。
試驗專業題目
一項2期、隨機、雙盲、安慰劑對照、平行研究,旨在評估皮下注射BW-00112治療重度高甘油三酯血癥受試者的有效性和安全性
主要入選標準
1.知情同意時年齡為 18 歲至 75 歲(含)的男性或女性。
2.篩選時有 TG ≥ 500 mg/dL(5.6 mmol/L)且 ≤ 4000 mg/dL(45 mmol/L)的病史證據。
3.篩選時至少有兩次檢測空腹 TG ≥ 500mg/dL(5.6 mmol/L)。
4.接受穩定的調脂飲食,加藥物(例如他汀類、煙酸、omega-3 脂肪酸)
治療,調脂飲食和藥物劑量應在篩選前穩定至少 4 周(貝特類 6 周,PCSK9 抑制劑 8 周)。
5.篩選時體質指數(BMI)為 18-40 kg/㎡(含)。
6.愿意在整個研究期間維持之前推薦的飲食和運動方案,遵守生活方式的要求。
7.愿意在整個研究期間,男性每周飲酒不超過 21 單位,女性每周飲酒不超過 14 單位。愿意在每次研究訪視前 24 小時內避免飲酒。
8.女性須處于非妊娠期和非哺乳期,或是手術絕育或絕經后。有生育能力的女性如果她們在篩選前 28 天至最后一次給藥后 24 周內使用高效避孕方法,則可以參加。
9.如果男性受試者的伴侶在篩選至最后一次給藥后 24 周內可能妊娠,則男性受試者同意使用可接受的避孕方法。
排除標準
1.首次給藥第 1 天前 12 周內發生急性胰腺炎。
2. 首次給藥第 1 天前 24 周內發生急性心血管事件或手術或在研究期間計劃接受這些手術。
3. 首次給藥第 1 天前 12 周內接受過較大的手術、有重大外傷或在研究期間需要接受住院治療的擇期手術的受試者。
4. 受試者篩選時有未控制的高血壓。
5. 篩選時心力衰竭紐約心功能分級(NYHA)為 2、3、4 級或已知的左室射血分數<30%。
6. 任何會影響血脂或脂蛋白的有臨床意義的未控制性疾病。
7. 有腫瘤史或現病史,已治愈的皮膚基底細胞癌或鱗狀細胞癌或子宮頸原位癌除外。
8. 任何研究者認為會導致受試者面臨風險,干擾參與研究或干擾研究結果的醫學或精神狀況。
9. 首次給藥第 1 天前 5 年內有酒精和/或藥物濫用史。
10. 首次給藥第 1 天前 6 個月內使用洛美他派或 4 周內接受血脂分離或血漿置換或計劃在研究期間接受這些治療。
11. 乙酰半乳糖胺(GalNAc)過敏反應史。
12. 首次給藥第 1 天前 12 個月內使用寡核苷酸。
13. 首次給藥第 1 天前 30 天或 5 個半衰期(以較長者為準)內參加過其他藥物臨床試驗者。
14. 篩選時臨床實驗室檢查異常。
15. 人類免疫缺陷病毒(HIV)感染、乙型肝炎病毒(HBV)血清陽性、丙型肝炎病毒(HCV)血清陽性或梅毒感染。
16. 篩選時任何有臨床意義的 12 導聯心電圖發現使受試者參與研究面臨風險或干擾。
17. 篩選前 30 天內獻血或失血超過 200mL。
18. 研究者判斷受試者不適合入組或干擾參與或完成研究的任何情況。
參與機構
