
一、研究概要
TQH2722是正大天晴研發的1類生物制品,TQH2722是集團附屬公司正大天晴藥業集團南京順欣制藥有限公司與博奧信生物技術(南京)有限公司共同開發的一種靶向白細胞介素4受體α(IL-4Rα)的人源化單克隆抗體,可導致白細胞介素-4(IL-4)和白細胞介素-13(IL-13)信號的雙重阻斷,抑制2型炎癥通路,從而達到控制如特應性皮炎、哮喘、慢性鼻竇炎等2型炎癥性疾病的目的。
二、主要入選標準
1.年齡為18歲至75歲(含兩端值),男女不限。
2.符合《中國慢性鼻竇炎診斷和治療指南(2018)》診斷標準的雙側慢性鼻竇炎(伴或不伴鼻息肉)。
3.在篩選期之前2年內接受過全身性糖皮質激素治療(至少1個療程潑尼松0.5-1mg/kg/天或等效劑量,持續最少5天),但仍存在雙側慢性鼻竇炎;和/或對全身性糖皮質激素有藥物禁忌癥/不耐受的患者,和(或)在篩選期前的6個月之前接受過鼻竇手術治療。
4.在篩選期之前,受試者必須曾經使用過較穩定劑量的鼻用糖皮質激素(INCS)超過4周;對于在篩選前使用INCS替代產品而非MFNS的受試者,受試者愿意在在研究期間改用MFNS。
5.合并哮喘的受試者在篩選期前至少4周內開始吸入穩定劑量的糖皮質激素治療,并可接受在整個研究期間吸入糖皮質激素劑量維持不變。
僅對 A 部分
1) 在篩選和隨機時,經鼻內鏡評估的雙側鼻息肉評分(NPS)≥5,且每側鼻孔評分≥2;
2) 篩選時及隨機時鼻塞評分(NCS)≥2;
3) 在篩選之前,同時持續存在下述癥狀至少 8周:
①鼻塞;②其他任一癥狀如嗅覺減退/喪失或流涕;
僅對 B 部分
1) 參與者必須在 CT 掃描中有雙側鼻竇炎癥且雙側LMK總分≥8分, 并且雙側篩 竇渾濁。
2) 在訪視1和隨機時,經鼻內鏡檢查確認無鼻息肉。
3) 受試者必須在訪視1前至少連續4周持續有嗅覺減退癥狀。
4) 受試者存在中度或重度嗅覺喪失癥狀,嗅覺喪失評分≥2分且隨機周平均嚴重程度≥2分。
5) 訪視1(日評分)和訪視2(周平均評分)時的sTSS(NC、鼻涕、面部疼痛/壓力)必須≥2分。
6) 篩選時血液嗜酸性粒細胞滿足以下任一條件的參與者:
? 血液嗜酸性粒細胞計數≥300 個細胞/mm3(受試者伴或不伴有哮喘);
? 血液嗜酸性粒細胞百分比≥6.9%且受試者不伴有哮喘;
? 血液嗜酸性粒細胞百分比≥3.7%且受試者伴有哮喘。
三、主要排除標準
1.活動性自身免疫性疾病或疑似免疫抑制者。
2.具有惡性腫瘤病史。
3.已接受了以下治療的受試者:
1) 篩選前 6個月內接受過鼻竇手術或鼻腔鼻竇手術;
2) 篩選前8周或者5個半衰期內接受過單克隆抗體類藥物治療,包括但不限于貝利珠單抗、美泊利單抗、奧馬珠單抗、白藜蘆單抗、度普利尤單抗、其他同類藥物(IL-4R抑制劑)等;
3) 在篩選前8周或者5個半衰期內接受過免疫抑制劑治療(包括但不限于環磷酰胺、環孢素、干擾素y、硫唑嘌呤、甲氨蝶呤、麥考酚酯和他克莫司等);
4) 篩選前8周或者5個半衰期內使用其他非生物制劑類試驗藥物;
5) 篩選訪視前30天內靜脈注射免疫球蛋白(IVIG)治療和/或進行過血漿置換;
6) 在隨機時接受白三烯拮抗劑/調節劑的受試者(隨機前連續使用穩定劑量的白三烯調節劑>30天的受試者可以入組);
7) 在篩選前3個月內開始過敏原免疫治療,或計劃在研究期內開始該治療或計劃在研究期間改變治療劑量;
8) 篩選前4周內接種過減毒活疫苗或計劃在研究期間接種減毒活疫苗;
9) 隨機前4周內使用全身性糖皮質激素;
10) 隨機前4周內,患慢性活動性或急性感染需要使用抗生素、抗病毒藥、抗寄生蟲藥、抗原蟲藥,或者抗真菌藥的全身性治療,或者隨機前4周內患有可能尚未接受抗病毒治療的病毒感染性疾病;
4.合并哮喘的患者如果存在以下情況,則需排除:a.第一秒鐘用力呼氣量(FEV1)≤正常預計值的50%,或b.篩選前90天內哮喘急性加重需要住院治療(>24小時),或c正在使用每日劑量高于1000mcg氟替卡松或等效的吸入性糖皮質激素(ICS)。
5.無法使用糠酸莫米松鼻噴霧劑的受試者。
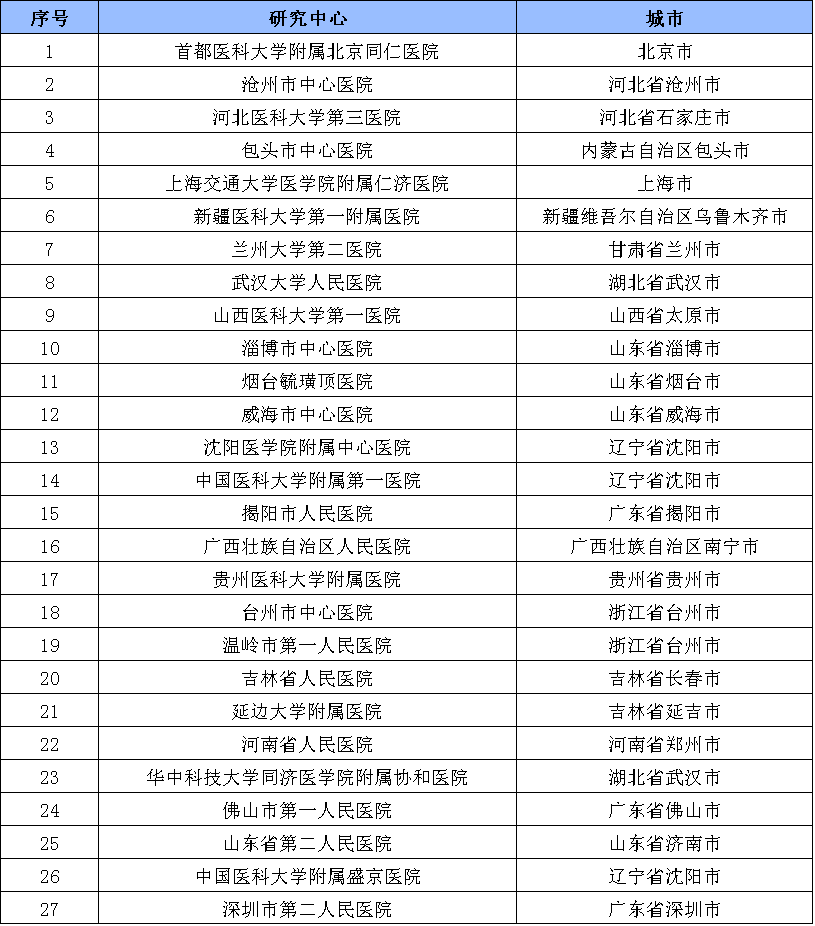
四、參與機構
一、研究概要
TQH2722是正大天晴研發的1類生物制品,TQH2722是集團附屬公司正大天晴藥業集團南京順欣制藥有限公司與博奧信生物技術(南京)有限公司共同開發的一種靶向白細胞介素4受體α(IL-4Rα)的人源化單克隆抗體,可導致白細胞介素-4(IL-4)和白細胞介素-13(IL-13)信號的雙重阻斷,抑制2型炎癥通路,從而達到控制如特應性皮炎、哮喘、慢性鼻竇炎等2型炎癥性疾病的目的。
二、主要入選標準
1.年齡為18歲至75歲(含兩端值),男女不限。
2.符合《中國慢性鼻竇炎診斷和治療指南(2018)》診斷標準的雙側慢性鼻竇炎(伴或不伴鼻息肉)。
3.在篩選期之前2年內接受過全身性糖皮質激素治療(至少1個療程潑尼松0.5-1mg/kg/天或等效劑量,持續最少5天),但仍存在雙側慢性鼻竇炎;和/或對全身性糖皮質激素有藥物禁忌癥/不耐受的患者,和(或)在篩選期前的6個月之前接受過鼻竇手術治療。
4.在篩選期之前,受試者必須曾經使用過較穩定劑量的鼻用糖皮質激素(INCS)超過4周;對于在篩選前使用INCS替代產品而非MFNS的受試者,受試者愿意在在研究期間改用MFNS。
5.合并哮喘的受試者在篩選期前至少4周內開始吸入穩定劑量的糖皮質激素治療,并可接受在整個研究期間吸入糖皮質激素劑量維持不變。
僅對 A 部分
1) 在篩選和隨機時,經鼻內鏡評估的雙側鼻息肉評分(NPS)≥5,且每側鼻孔評分≥2;
2) 篩選時及隨機時鼻塞評分(NCS)≥2;
3) 在篩選之前,同時持續存在下述癥狀至少 8周:
①鼻塞;②其他任一癥狀如嗅覺減退/喪失或流涕;
僅對 B 部分
1) 參與者必須在 CT 掃描中有雙側鼻竇炎癥且雙側LMK總分≥8分, 并且雙側篩 竇渾濁。
2) 在訪視1和隨機時,經鼻內鏡檢查確認無鼻息肉。
3) 受試者必須在訪視1前至少連續4周持續有嗅覺減退癥狀。
4) 受試者存在中度或重度嗅覺喪失癥狀,嗅覺喪失評分≥2分且隨機周平均嚴重程度≥2分。
5) 訪視1(日評分)和訪視2(周平均評分)時的sTSS(NC、鼻涕、面部疼痛/壓力)必須≥2分。
6) 篩選時血液嗜酸性粒細胞滿足以下任一條件的參與者:
? 血液嗜酸性粒細胞計數≥300 個細胞/mm3(受試者伴或不伴有哮喘);
? 血液嗜酸性粒細胞百分比≥6.9%且受試者不伴有哮喘;
? 血液嗜酸性粒細胞百分比≥3.7%且受試者伴有哮喘。
三、主要排除標準
1.活動性自身免疫性疾病或疑似免疫抑制者。
2.具有惡性腫瘤病史。
3.已接受了以下治療的受試者:
1) 篩選前 6個月內接受過鼻竇手術或鼻腔鼻竇手術;
2) 篩選前8周或者5個半衰期內接受過單克隆抗體類藥物治療,包括但不限于貝利珠單抗、美泊利單抗、奧馬珠單抗、白藜蘆單抗、度普利尤單抗、其他同類藥物(IL-4R抑制劑)等;
3) 在篩選前8周或者5個半衰期內接受過免疫抑制劑治療(包括但不限于環磷酰胺、環孢素、干擾素y、硫唑嘌呤、甲氨蝶呤、麥考酚酯和他克莫司等);
4) 篩選前8周或者5個半衰期內使用其他非生物制劑類試驗藥物;
5) 篩選訪視前30天內靜脈注射免疫球蛋白(IVIG)治療和/或進行過血漿置換;
6) 在隨機時接受白三烯拮抗劑/調節劑的受試者(隨機前連續使用穩定劑量的白三烯調節劑>30天的受試者可以入組);
7) 在篩選前3個月內開始過敏原免疫治療,或計劃在研究期內開始該治療或計劃在研究期間改變治療劑量;
8) 篩選前4周內接種過減毒活疫苗或計劃在研究期間接種減毒活疫苗;
9) 隨機前4周內使用全身性糖皮質激素;
10) 隨機前4周內,患慢性活動性或急性感染需要使用抗生素、抗病毒藥、抗寄生蟲藥、抗原蟲藥,或者抗真菌藥的全身性治療,或者隨機前4周內患有可能尚未接受抗病毒治療的病毒感染性疾病;
4.合并哮喘的患者如果存在以下情況,則需排除:a.第一秒鐘用力呼氣量(FEV1)≤正常預計值的50%,或b.篩選前90天內哮喘急性加重需要住院治療(>24小時),或c正在使用每日劑量高于1000mcg氟替卡松或等效的吸入性糖皮質激素(ICS)。
5.無法使用糠酸莫米松鼻噴霧劑的受試者。
四、參與機構
